12005 CAPA in der Medizintechnik
|
Effiziente CAPA-Prozesse (Corrective and Preventive Actions) sind der Schlüssel, um Patientensicherheit zu garantieren und strenge regulatorische Anforderungen wie die der ISO 13485, der MDR und den Regelungen der FDA zu erfüllen. Dieser Artikel beleuchtet praktische Ansätze – von der präzisen Ursachenanalyse bis hin zur nachhaltigen Fehlerprävention – und zeigt, wie Sie mit einem strukturierten CAPA-System Risiken minimieren, Compliance sichern und die Qualität Ihrer Produkte kontinuierlich steigern können. Zudem erfahren Sie, wie Digitalisierung und KI CAPA auf ein neues Level heben. Lernen Sie, wie Ihre Medizintechnik-Organisation von CAPA profitiert und zukunftssicher wird. Arbeitshilfen: von: |
1 Einleitung
Das Schiff sinkt
Stellen Sie sich vor: Sie befinden sich auf einem Segeltörn auf hoher See. Sie hören, dass die Bilgepumpe Wasser aus dem Rumpf pumpt. Was zunächst wie eine normale Funktion aussieht, entwickelt sich schnell zu einem beunruhigenden Signal. Die Pumpe läuft nahezu ununterbrochen. Dieses untypische Verhalten deutet darauf hin, dass deutlich mehr Wasser als üblich in Ihr Schiff eindringt. Es ist ein klares Alarmsignal, das Schiff droht zu sinken (s. Abb. 1).
Abb. 1: Sinkendes Segelboot
Stellen Sie sich vor: Sie befinden sich auf einem Segeltörn auf hoher See. Sie hören, dass die Bilgepumpe Wasser aus dem Rumpf pumpt. Was zunächst wie eine normale Funktion aussieht, entwickelt sich schnell zu einem beunruhigenden Signal. Die Pumpe läuft nahezu ununterbrochen. Dieses untypische Verhalten deutet darauf hin, dass deutlich mehr Wasser als üblich in Ihr Schiff eindringt. Es ist ein klares Alarmsignal, das Schiff droht zu sinken (s. Abb. 1).
Korrekturmaßnahme
Was tun Sie? Sie suchen das Leck und stellen fest, dass das Wasser im Bereich der Welle- und Ruderanlage eintritt. Um ein Sinken zu verhindern, dichten Sie die Stelle zunächst provisorisch ab. Zurück im Hafen untersuchen Sie die Ursache genauer und finden eine unzureichende Dichtungsmanschette an der Ruderanlage. Sie leiten somit eine Korrekturmaßnahme ein und tauschen die Dichtung aus.
Was tun Sie? Sie suchen das Leck und stellen fest, dass das Wasser im Bereich der Welle- und Ruderanlage eintritt. Um ein Sinken zu verhindern, dichten Sie die Stelle zunächst provisorisch ab. Zurück im Hafen untersuchen Sie die Ursache genauer und finden eine unzureichende Dichtungsmanschette an der Ruderanlage. Sie leiten somit eine Korrekturmaßnahme ein und tauschen die Dichtung aus.
Vorbeugemaßnahme
Um ähnliche Leckagen bei anderen Schiffen künftig zu verhindern, muss der Hersteller sowohl die Dichtungsmanschette als auch den Montageprozess überarbeiten. Das übergeordnete Ziel besteht darin, das Risiko zukünftiger Fehler durch die systematische Optimierung von Design und Prozessen nachhaltig zu minimieren. Das wird Vorbeugemaßnahme genannt.
Um ähnliche Leckagen bei anderen Schiffen künftig zu verhindern, muss der Hersteller sowohl die Dichtungsmanschette als auch den Montageprozess überarbeiten. Das übergeordnete Ziel besteht darin, das Risiko zukünftiger Fehler durch die systematische Optimierung von Design und Prozessen nachhaltig zu minimieren. Das wird Vorbeugemaßnahme genannt.
2 Definition CAPA
Eckpfeiler für Qualität und Compliance
Dieses Beispiel „Das Schiff sinkt” verdeutlicht das Prinzip von CAPA (s. Abb. 2). Das Akronym setzt sich zusammen aus:
Dieses Beispiel „Das Schiff sinkt” verdeutlicht das Prinzip von CAPA (s. Abb. 2). Das Akronym setzt sich zusammen aus:
| • | CA = Corrective Action oder Korrekturmaßnahme |
| • | PA = Preventive Action oder Vorbeugemaßnahme |
In der Praxis werden die Begriffe „Korrekturmaßnahme”, „Vorbeugemaßnahme” oder auch „Korrektur” oft verwechselt oder nicht richtig verwendet. Für die Umsetzung gemäß ISO 13485, FDA und MDR ist eine klare Abgrenzung entscheidend. Im Folgenden finden Sie die Definitionen und den Zusammenhang, wie sie in den relevanten Regelwerken verwendet werden.
Anmerkung
Bei der Abgrenzung von Korrektur, Korrekturmaßnahme und Vorbeugemaßnahme ist zu beachten, dass die Normen zwar ähnliche Ziele verfolgen, jedoch unterschiedliche Schwerpunkte setzen. Ein direkter Widerspruch besteht nicht. Allerdings gibt es Unterschiede in der Terminologie und der Umsetzungsschärfe, die Sie in Einzelfällen beachten müssen.
2.1 Korrektur (Correction)
Soforthilfe
Dies ist eine sofortige Maßnahme, die ergriffen wird, um einen festgestellten Fehler oder eine Abweichung zu beheben. Dabei wird die Ursache des Problems nicht analysiert oder beseitigt.
Dies ist eine sofortige Maßnahme, die ergriffen wird, um einen festgestellten Fehler oder eine Abweichung zu beheben. Dabei wird die Ursache des Problems nicht analysiert oder beseitigt.
| • | Ziel: den bestehenden Fehler schnell und effektiv beheben, um akute Auswirkungen zu verhindern |
| • | Definition: unmittelbare Maßnahme zur Behebung eines festgestellten Fehlers oder einer Abweichung ohne eine Ursachenanalyse |
| • | Zweck: Sicherstellung, dass fehlerhafte Produkte nicht in Umlauf gelangen oder verwendet werden |
| • | Wann: direkt nach Entdeckung des Fehlers |
| • | Beispiel: Ein Katheter wird bei der Qualitätskontrolle als zu lang erkannt. Die Korrektur besteht darin, ihn auf die richtige Länge zu kürzen oder auszusortieren. |
2.2 Korrekturmaßnahme (Corrective Action)
Systematische Maßnahme
Dies ist eine gezielte, systematische Maßnahme zur Beseitigung der Ursache eines bereits aufgetretenen Fehlers.
Dies ist eine gezielte, systematische Maßnahme zur Beseitigung der Ursache eines bereits aufgetretenen Fehlers.
| • | Ziel: Wiederholungen desselben Fehlers durch eine Ursachenanalyse und gezielte Maßnahmen verhindern |
| • | Definition: systematisches Vorgehen zur Beseitigung der Ursache eines bereits aufgetretenen Fehlers |
| • | Zweck: langfristige Fehlervermeidung durch nachhaltige Problemlösung |
| • | Wann: unmittelbar nach dem Auftreten eines Fehlers und Durchführung einer Ursachenanalyse |
| • | Beispiel: Bei der Untersuchung des zu lang geschnittenen Katheters wurde festgestellt, dass die Schneidevorrichtung fehlerhaft eingestellt war. Als Korrekturmaßnahmen wurden eine Schulung des Personals, die Kalibrierung der Schneidevorrichtung sowie die Erstellung einer neuen, klareren Arbeitsanweisung, die den Schneideprozess genau beschreibt, beschlossen. |
2.3 Vorbeugemaßnahme (Preventive Action)
Risikoprävention
Dies ist eine proaktive Maßnahme, die ergriffen wird, um die Ursache eines potenziellen Fehlers zu beseitigen, bevor dieser auftritt. Sie basiert auf Risikobewertungen, Audits oder Trendanalysen potenzieller Schwachstellen.
Dies ist eine proaktive Maßnahme, die ergriffen wird, um die Ursache eines potenziellen Fehlers zu beseitigen, bevor dieser auftritt. Sie basiert auf Risikobewertungen, Audits oder Trendanalysen potenzieller Schwachstellen.
| • | Ziel: mögliche Risiken frühzeitig erkennen und das Auftreten von Fehlern verhindern |
| • | Definition: vorbeugende Maßnahme zur Vermeidung potenzieller Fehler |
| • | Zweck: Qualität und Sicherheit erhöhen, indem Risiken bereits vor ihrem Eintreten mit Maßnahmen adressiert werden |
| • | Wann: vor dem Auftreten eines Fehlers, wie z. B. bei der Risikoanalyse, Prozessentwicklung oder bei der Einführung neuer Produkte |
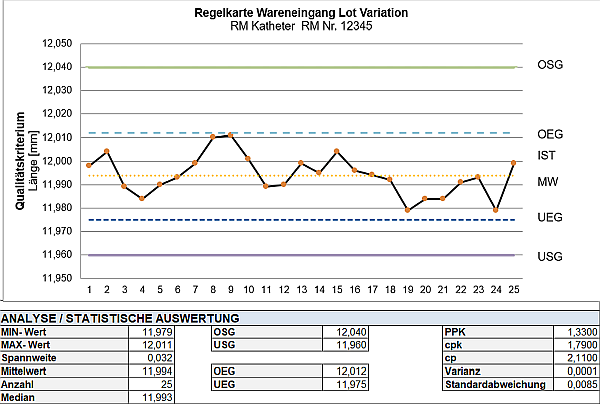
| • | Beispiel: Bei der Neuentwicklung des Katheters wird mittels Risikoanalyse geprüft, an welchen Stellen im Prozess Fehler entstehen könnten. Dabei wurde das Abschneiden als potenzieller Fehler identifiziert. Um dem vorzubeugen, wird ein neuer, automatisierter Schneideprozess eingeführt, der die Fehlerquelle eliminiert. Zusätzlich wird mittels Regelkarte eine stichprobenartige Überprüfung der Schnittlänge in den Prozess integriert, um die Genauigkeit kontinuierlich zu überwachen und Problemen vorzubeugen (s. Abb. 3). |
3 Mehr als nur Fehlerbehebung
Schlüssel zur kontinuierlichen Verbesserung
CAPA geht weit über die reine Problemlösung hinaus. Es handelt sich um einen systematischen und lückenlosen Ansatz, um die Grundursache von Problemen zu identifizieren, zu beseitigen und deren erneutes Auftreten zu verhindern, was im Englischen Root Cause Analysis (RCA) genannt wird. Im Zusammenhang mit Medizinprodukten ist dies unerlässlich, um die Patientensicherheit und Produktqualität zu gewährleisten. CAPA ist daher ein absolutes Muss für jedes Produkt, das Leben retten oder verbessern soll, und ist daher allgemein im Qualitätsmanagementsystem (QMS) angesiedelt.
CAPA geht weit über die reine Problemlösung hinaus. Es handelt sich um einen systematischen und lückenlosen Ansatz, um die Grundursache von Problemen zu identifizieren, zu beseitigen und deren erneutes Auftreten zu verhindern, was im Englischen Root Cause Analysis (RCA) genannt wird. Im Zusammenhang mit Medizinprodukten ist dies unerlässlich, um die Patientensicherheit und Produktqualität zu gewährleisten. CAPA ist daher ein absolutes Muss für jedes Produkt, das Leben retten oder verbessern soll, und ist daher allgemein im Qualitätsmanagementsystem (QMS) angesiedelt.
3.1 Methode, Prozess oder beides?
CAPA ist eine grundlegende Methode und ein umfassender, systematischer Prozess im QMS. Diese Doppelrolle ist für Unternehmen von entscheidender Bedeutung.
3.2 CAPA als Prozess
Primär wird CAPA als ein strukturierter Prozess innerhalb eines QMS verstanden. Es ist ein definierter Ablauf von aufeinanderfolgenden Schritten. Sie werden systematisch durchlaufen, um Qualitätsprobleme zu lösen und deren Wiederauftreten zu verhindern. Die typischen Phasen dieses Prozesses sind (s. Abb. 4):
| Schritt 1 | Problemidentifikation: Erkennen, dass ein Problem oder ein potenzielles Problem existiert |
| Schritt 2 | Bewertung/Priorisierung: Einschätzung des Ausmaßes und der Dringlichkeit des Problems |
| Schritt 3 | Ursachenanalyse: Dies ist die entscheidende Phase, um die Ursache des Problems zu finden und nicht nur dessen Symptome. |
| Schritt 4 | Maßnahmenplanung: Entwicklung von Korrektur- und/oder Vorbeugungsmaßnahmen |
| Schritt 5 | Implementierung: Durchführung bzw. Umsetzung der geplanten Maßnahmen |
| Schritt 6 | Verifizierung der Effektivität: Überprüfung, ob die Maßnahmen das Problem tatsächlich behoben und ein Wiederauftreten verhindert haben |
| Schritt 7 | Dokumentation: die lückenlose Aufzeichnung aller Schritte |
Dieser Prozess ist wiederholbar, messbar und oft in Standardarbeitsanweisungen (SOPs) festgelegt.