13102 DRBFM − Design Review Based on Failure Mode
|
Kürzer werdende Entwicklungszeiten bei innovativen und komplexen Medizinprodukten erfordern ein Umdenken im Entwicklungsmanagement. Kleine Änderungen einer Produkt- oder Prozessspezifikation können, wenn die erforderliche Qualität nicht erreicht wird, eine wesentliche Verschiebung von Projektkosten oder Markteinführungsterminen zur Folge haben. Um die zugeteilten Ressourcen effizient zu nutzen, benötigen Sie außer einem durchdachten Multiprojektmanagement auch ein sensibles Entwicklungs- und Änderungsmanagement.
Praktische Beispiele sollen Ihnen den Einstieg in die DRBFM-Methode ermöglichen. Der Artikel soll Unternehmen dazu ermutigen, ihre Änderungen mittels DRBFM zu analysieren, um damit kostenintensive Folgefehler zu vermeiden. Arbeitshilfen: von: |
1 Situation in den Unternehmen
Umdenken im Projekt- und Entwicklungsmanagement
Aufgrund der zunehmenden Komplexität und Unsicherheiten von gesellschaftlichen, ökonomischen, wirtschaftlichen und umweltlichen Rahmenbedingungen wie
Aufgrund der zunehmenden Komplexität und Unsicherheiten von gesellschaftlichen, ökonomischen, wirtschaftlichen und umweltlichen Rahmenbedingungen wie
| • | Globalisierung |
| • | politischer Veränderung |
| • | Klimawandel |
| • | technologischen Neuerungen |
| • | digitalem Wandel der Industrie |
| • | verändertem Energie- und Rohstoffmarkt |
| • | höheren und verschiedenartigeren Anforderungen an die Produktzulassungen |
müssen die Unternehmen vielfältige Einflüsse auf ihre Produkte inklusive deren Herstellung beachten und diese risikoarm managen. Bereits eine kleine Änderung in einer Prozesskette kann große Einflüsse auf die Gesamtheit der Qualität, der Produktivität und den Gewinn haben (s. Abb. 1). Dadurch werden
| • | die täglichen Unternehmensabläufe gestört. |
| • | Prozesse erfüllen die geplante Qualität nicht. |
| • | Der Produktionsoutput wird nicht erreicht. |
| • | Produkte am Markt erfüllen nicht die Performance. |
| • | Kundenreklamationen und die daraus folgenden Nachbesserungen überfordern die Serviceabteilungen. |
| • | Rückrufaktion führt zu Imageschaden. |
| • | Kapazitäts- sowie Ressourcenmangel schränken die Kreativität ein und führen zu einem überhasteten Problemlösungsdenken, das zu Folgeproblemen und nicht zu einem robusten Design führt. |
Entwicklung beeinflusst Kosten
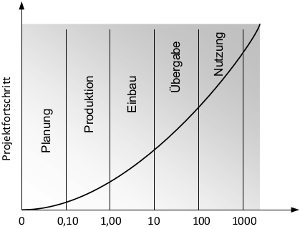
Je später ein Fehler im Produktlebenszyklus auftritt, desto höher sind die finanziellen Folgen. Die Erfahrung aus dem Qualitätsmanagement zeigt, dass die Kosten der Fehlerverhütung/-behebung in jeder Phase exponentiell um den Faktor 10 steigen (s. Abb. 2).
Abb. 2: 10er-Regel
Je später ein Fehler im Produktlebenszyklus auftritt, desto höher sind die finanziellen Folgen. Die Erfahrung aus dem Qualitätsmanagement zeigt, dass die Kosten der Fehlerverhütung/-behebung in jeder Phase exponentiell um den Faktor 10 steigen (s. Abb. 2).
Produktlebenszyklen werden kürzer, Entwicklungszeiten auch?
Jedes Unternehmen strebt nach einem langfristigen und nachhaltigem Erfolg. Mit den Gegebenheiten wie
Jedes Unternehmen strebt nach einem langfristigen und nachhaltigem Erfolg. Mit den Gegebenheiten wie
| • | kürzer werdenden Produktlebenszyklen |
| • | Anpassung der Produkte und deren Eigenschaften an den jeweiligen ländertypischen Bedarf |
| • | Forderung von Produktinnovationen bzw. Produktvarianten durch den Kunden |
| • | steigender Komplexität der Pharma- und Medizinprodukte mit einer gleichzeitig höheren Produktzulassungsanforderung |
führt dies unter anderem zu einem notwendigen Umdenken im Projekt- bzw. Entwicklungsmanagement.
Abgestimmtes Projektmanagement
Dafür benötigen Sie geeignete Prozesse, Methoden und Tools, um die Projekte effizient und effektiv abwickeln zu können. Einige Faktoren für ein gutes Projekt- bzw. Entwicklungsmanagement sind:
Dafür benötigen Sie geeignete Prozesse, Methoden und Tools, um die Projekte effizient und effektiv abwickeln zu können. Einige Faktoren für ein gutes Projekt- bzw. Entwicklungsmanagement sind:
| • | eine Vision |
| • | gemeinsame Unternehmensziele und Strategien |
| • | klare Zieldefinition und Verantwortungsstrukturen |
| • | richtige Projektorganisationsform (klassisch, agil, hybrid) |
| • | Priorisieren von Projekten mit klarer Transparenz von Abhängigkeiten |
| • | Projektcontrolling |
| • | strategische Ressourcenplanung |
| • | transparente Entscheidungen |
| • | gute Teamarbeit |
| • | kompetente Mitarbeiter mit einer durchdachten Teamzusammensetzung |
| • | standardisiertes Krisenmanagement |
Ist das Management abgestimmt (s. Abb. 3), können Sie die Projektlaufzeit einhalten und im besten Fall das Projekt frühzeitig beenden. Bei einem Unternehmen, das mit Multiprojektmanagement plant, bedeutet dies eine projektübergreifende Planung, Überwachung, Koordination und Steuerung. Beim Multiprojektmanagement besteht die Gefahr, dass wenn ein Projekt sich verzögert, dies eine Verschiebung auf alle anderen Projekte zur Folge hat. Das kann die gesamte Unternehmensplanung in Gefahr bringen (s. Abb. 4).
DIN 69909
Für das Management von Projektportfolios, Multiprojekten, Programmen und Projekten ist die DIN 69909 [1] erstellt worden. Darin finden Sie Inhalte wie
Für das Management von Projektportfolios, Multiprojekten, Programmen und Projekten ist die DIN 69909 [1] erstellt worden. Darin finden Sie Inhalte wie
| • | Begrifflichkeiten für ein gemeinsames Verständnis, |
| • | Entwicklung, Einführung, Aufrechterhaltung und Verbesserung von Projekten, |
| • | Beratung und Schulung sowie |
| • | Softwareprogramme. |
Tipp
Projektplanungshilfe
Projektplanungshilfe
| • | Planen Sie besser grob und vollständig als zu detailliert und unvollständig. |
| • | Planen Sie alle Projekte und Ressourcen. Vergessene oder unterschätzte Kleinprojekte bringt ihr Multiprojektmanagement in Gefahr. |
| • | Planen Sie besser mit geringer Funktionalität und steigern Sie diese mit zunehmender Planungserfahrung. |
Um die zugeteilten Ressourcen effizient zu nutzen, benötigen Sie außer einem durchdachten Multiprojektmanagement auch ein sensibles Entwicklungs- und Änderungsmanagement. Dies versetzt Sie in die Lage, proaktiv feine Ansätze von Abweichungen zu erkennen, bevor ein bestandsgefährdendes Problem heranwächst. Gewohnte Tätigkeiten müssen auf eine agile Organisationsform transformiert werden. Nur mit einem flexiblen und zukunftsorientierten Handeln können Sie in kürzester Zeit auf Veränderungen und neue Marktanforderungen reagieren.
1.1 Erfolgsfaktoren
Erfolg ist kein Zufall
Es gibt viele Faktoren, die ein erfolgreiches von einem nicht erfolgreichen Unternehmen unterscheiden. Analysieren Sie erfolgreiche Unternehmen, werden Sie erkennen, dass der Erfolg nicht in den Maschinen, Anlagen, Werkzeugen oder Verfahren liegt, sondern in
Es gibt viele Faktoren, die ein erfolgreiches von einem nicht erfolgreichen Unternehmen unterscheiden. Analysieren Sie erfolgreiche Unternehmen, werden Sie erkennen, dass der Erfolg nicht in den Maschinen, Anlagen, Werkzeugen oder Verfahren liegt, sondern in
| • | der Unternehmenskultur, |
| • | den Managementmethoden, |
| • | der Zieldefinition, |
| • | dem Einsatz von Digitalisierung und |
| • | der Art der Kommunikation. |
Risikofaktor Produktänderung
Zu dem Erfolgsfaktor Managementmethode zählt ein ausgezeichnetes Ablaufmanagement. Darunter sind folgende drei Punkte von großer Bedeutung:
Zu dem Erfolgsfaktor Managementmethode zählt ein ausgezeichnetes Ablaufmanagement. Darunter sind folgende drei Punkte von großer Bedeutung:
| • | Zeitmanagement, |
| • | Qualitätsmanagement und |
| • | Kostenmanagement. |
Bestandteile zukunftsfähiger visionäre Ablaufszenarien enthalten unter anderem
| • | Entwicklungsmanagement, |
| • | Änderungsmanagement, |
| • | Wissensmanagement, |
| • | Dokumentationsmanagement oder |
| • | Risikomanagement. |
Vor allem das Änderungsmanagement hat eine große Bedeutung. Traditionelle Herstellerunternehmen greifen auf einen großen Wissens- und Erfahrungsschatz zurück. Dieser muss gesichert sein, sodass nur wenige komplette Neuentwicklungen erstellt werden müssen. Meist sind die neuen Produkte qualifizierte Weiterentwicklungen von etablierten Produkten. Dabei wird auf bestehende und vor allem bewährte Komponenten zurückgegriffen.
Dieses Änderungsmanagement (s. Abb. 5) soll hier näher betrachtet werden, wobei die Methode DRBFM allmählich zum entscheidenden Wettbewerbsvorteil avanciert.
Praxisbeispiel
Ein Hersteller eines Medizinprodukts hat einen bewährten Griff. Dieser wird von den Kunden, Patienten und Ärzten akzeptiert. Es gibt keinerlei Reklamationen und der Wettbewerber hat auch in der Zukunft keinen besseren Griff auf dem Markt. Somit bestehen keine Gründe, diesen Griff zu ändern. In der Neuentwicklung wird der Katheter weiterentwickelt und optimiert.
Ein Hersteller eines Medizinprodukts hat einen bewährten Griff. Dieser wird von den Kunden, Patienten und Ärzten akzeptiert. Es gibt keinerlei Reklamationen und der Wettbewerber hat auch in der Zukunft keinen besseren Griff auf dem Markt. Somit bestehen keine Gründe, diesen Griff zu ändern. In der Neuentwicklung wird der Katheter weiterentwickelt und optimiert.
1.2 Was sind Änderungen?
Änderungen besitzen höchstes Fehlerpotenzial
Im Allgemeinen müssen Hersteller alle Änderungen an einem Medizinprodukt anhand der Vorgabe des MDCG 2020-3 [2] bewerten. Dabei wird festgestellt, ob es sich im Sinne von Artikel 120 MDR um eine zulassungsnotwendige Änderung bei den Behörden handelt oder nicht. Beispiele von Änderungen an einem Medizinprodukt sind:
Im Allgemeinen müssen Hersteller alle Änderungen an einem Medizinprodukt anhand der Vorgabe des MDCG 2020-3 [2] bewerten. Dabei wird festgestellt, ob es sich im Sinne von Artikel 120 MDR um eine zulassungsnotwendige Änderung bei den Behörden handelt oder nicht. Beispiele von Änderungen an einem Medizinprodukt sind:
| • | Änderungen bei der Herstellung:
| ||||||
| • | Änderung aufgrund einer notwendigen Standortverlagerung:
| ||||||
| • | Änderung des Designs oder Leistungsspektrums:
| ||||||
| • | Änderung in der Beschaffung:
| ||||||
| • | Änderung des Materials:
| ||||||
| • | Änderung an einem Betriebsmittel:
| ||||||
| • | Änderung der Sterilisationsmethode:
| ||||||
| • | Änderung der Verpackung:
| ||||||
| • | Änderungen aufgrund von Kostengründen:
| ||||||
| • | Änderungen aufgrund von Anforderungsgründen:
| ||||||
| • | Änderungen aufgrund von Innovationsdruck bzw. Technologiewandel:
|
Design Change
Die deutsche Definition von Design Change heißt „Änderung der Auslegung” eines Medizinprodukts. Das trifft zu, wenn sich am Entwurf des Medizinprodukts etwas ändert. Das ist nicht nur die Änderung des Designs eines Produkts. Darunter fällt jede Art einer Änderung nach der jeweiligen Zulassung. Dies ist unabhängig davon, ob diese meldepflichtig ist, oder nicht.
Die deutsche Definition von Design Change heißt „Änderung der Auslegung” eines Medizinprodukts. Das trifft zu, wenn sich am Entwurf des Medizinprodukts etwas ändert. Das ist nicht nur die Änderung des Designs eines Produkts. Darunter fällt jede Art einer Änderung nach der jeweiligen Zulassung. Dies ist unabhängig davon, ob diese meldepflichtig ist, oder nicht.
Tipp
Überprüfen Sie bei Ihren Änderungen, ob es eine normative Anforderung ist oder nicht. Die allgemeine Empfehlung ist, dass Sie jede Änderung am Prozess oder Produkt betrachten und auf Richtigkeit prüfen. Beachten Sie bitte, dass das höchste Fehlerpotenzial an einem Produkt in den Design- oder Prozessänderungen enthalten ist. Diese Gefahr steigt, je größer der Neuheitsgrad des Designs und die Komplexität des Produkts ist.
1.3 Normen und Zulassungen
Zulassungsbehörden haben erkannt, dass eine Änderung an einem Medizinprodukt ein hohes Fehlerpotenzial besitzt. Wird ein Fehler behoben, entstehen oft neue Probleme. Daher fordern die Behörden eine sorgfältige Untersuchung der potenziellen Lösung. Anbei Referenzen zu Normen und Leitlinien:
| • | MDCG 2020-3 [2] – Leitlinie der Medical Device Coordination GroupHersteller von Medizinprodukten müssen alle Änderungen anhand der Kriterien des MDCG 2020-3 bewerten, um festzustellen, ob es sich um wesentliche Änderungen im Sinne von Artikel 120 MDR handelt oder nicht. | ||||
| • | DIN EN ISO 14971 [3] – Norm über die Anwendung des Risikomanagements auf Medizinprodukte Diese Norm behandelt Prozesse zum Management von Risiken im Zusammenhang mit Medizinprodukten. Dabei muss der Hersteller Methoden zur Risikoanalyse, Risikobewertung, Risikobeherrschung, Bewertung des Gesamtrestrisikos, Überprüfung des Risikomanagements sowie Tätigkeiten während der Herstellung und der Herstellung nachgelagerter Phasen nachweisen. | ||||
| • | DIN EN ISO 13485 [4] – Norm über Qualitätsmanagementsysteme bei der Produktion von Medizinprodukten
| ||||
| • | 21 CFR § 820.30(i) [5] – Code of Federal Regulations – „Design changes”Zu den Anforderungen von der FDA (Food and Drug Administration, deutsch US-Behörde für Lebens- und Arzneimittel) heißt es im Zusammenhang „Design Changes” im Paragrafen 21 CFR § 820.30(i):„Jeder Hersteller muss Verfahren für die Identifizierung, Dokumentation, Validierung oder gegebenenfalls Verifizierung und Genehmigung von Konstruktionsänderungen vor ihrer Einführung prüfen.” |
2 Die Methode DRBFM
Die FMEA-Methode (FMEA = Failure Mode and Effects) hat sich in vielen Industriebereichen als ein effizientes Werkzeug zur Risikoanalyse bewährt. Bei Änderungen ist diese jedoch oft nicht ausreichend. Es empfiehlt sich zusätzliche Methoden, wie die DRBFM, anzuwenden.
Fehler so früh wie möglich im PEP vermeiden
DRBFM ist eine vorbeugende Fehlervermeidungsmethode im Qualitätsmanagement und wird bei Produkt- und Prozessänderungen (PEP = Produkt-Entwicklungsprozess) angewendet.
DRBFM ist eine vorbeugende Fehlervermeidungsmethode im Qualitätsmanagement und wird bei Produkt- und Prozessänderungen (PEP = Produkt-Entwicklungsprozess) angewendet.
Der Erfinder
Die Methode DRBFM wurde ursprünglich von bzw. für Toyota Motors im Jahre 1997 entwickelt. Der Qualitätsexperte und Professor an der Kyushu-Universität in Japan, Tatsuhiko Yoshimura wusste, dass Probleme bei bereits erfolgreich eingeführten Produkten auftraten, wenn Design- oder Prozessänderungen ohne eine gründliche Überprüfung vorgenommen wurden. Mit der Philosophie der Präventivmaßnahmen (Mizenboushi) schuf er die DRBFM-Philosophie für Toyota.
Die Methode DRBFM wurde ursprünglich von bzw. für Toyota Motors im Jahre 1997 entwickelt. Der Qualitätsexperte und Professor an der Kyushu-Universität in Japan, Tatsuhiko Yoshimura wusste, dass Probleme bei bereits erfolgreich eingeführten Produkten auftraten, wenn Design- oder Prozessänderungen ohne eine gründliche Überprüfung vorgenommen wurden. Mit der Philosophie der Präventivmaßnahmen (Mizenboushi) schuf er die DRBFM-Philosophie für Toyota.
Mizenboushi ist eine vorbeugende Maßnahme
Die Bedeutung: DRBFM ist das Akronym von Design Review Based on Failure Mode und teilt sich in zwei Bereiche auf:
Die Bedeutung: DRBFM ist das Akronym von Design Review Based on Failure Mode und teilt sich in zwei Bereiche auf:
| DR | steht für „Design Review” und bedeutet eine Überprüfung der Entwicklung durch interne und externe Experten, die selbst nicht am Projekt beteiligt sind. |
| BFM | steht für „Based on Failure Mode” und bedeutet, dass die Experten über mögliche Fehler zu einer geplanten Änderung nachdenken. |
Ziel
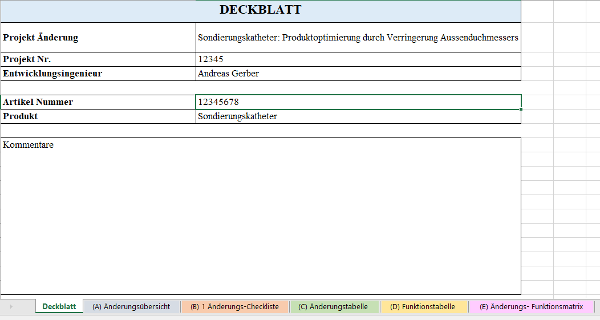
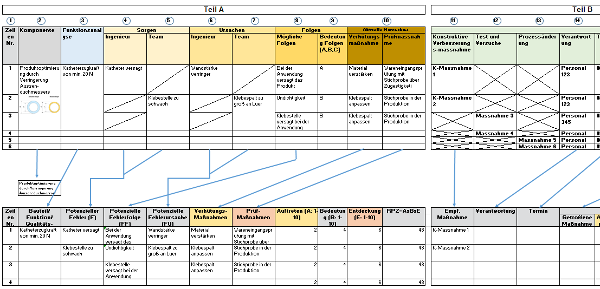
Die DRBFM-Methode sorgt dafür, dass das Design mit der Änderung bewertet und weiterhin die Qualitätsanforderung am Produkt erfüllt wird. Weiterhin werden alle potenziellen Fehler ermittelt, die infolge einer beabsichtigen Änderung und der daraus resultierenden unbeabsichtigten Veränderung am Produkt und Prozess entstehen können. Alle Fehler werden in dem DRBFM-Formblatt eingetragen und gegebenenfalls werden Maßnahmen zur Lösung definiert (s. Abb. 6).
Abb. 6: Bedarfe ermitteln
Die DRBFM-Methode sorgt dafür, dass das Design mit der Änderung bewertet und weiterhin die Qualitätsanforderung am Produkt erfüllt wird. Weiterhin werden alle potenziellen Fehler ermittelt, die infolge einer beabsichtigen Änderung und der daraus resultierenden unbeabsichtigten Veränderung am Produkt und Prozess entstehen können. Alle Fehler werden in dem DRBFM-Formblatt eingetragen und gegebenenfalls werden Maßnahmen zur Lösung definiert (s. Abb. 6).
Vorgehen
Die Methode ist eine entwicklungsbegleitende Kreativitätsmethode und zugleich eine Philosophie zur diskursorientierten Designfindung bzw. Designevaluierung (Verifikation und Validierung). Allgemeine Merkmale einer DRBFM sind
Die Methode ist eine entwicklungsbegleitende Kreativitätsmethode und zugleich eine Philosophie zur diskursorientierten Designfindung bzw. Designevaluierung (Verifikation und Validierung). Allgemeine Merkmale einer DRBFM sind
| • | wenig Formalismus |
| • | Konzentration auf die Problemfindung |
| • | Die Arbeitsmethode und Arbeitsmittel regt die Kreativität der Ingenieure und Teammitglieder an. |
Einsatzgebiet
DRBFM ist eine Methode für Änderungen aller Art. Damit wird sichergestellt, dass die hohe Qualität auch nach einer Änderung beibehalten wird.
DRBFM ist eine Methode für Änderungen aller Art. Damit wird sichergestellt, dass die hohe Qualität auch nach einer Änderung beibehalten wird.
Vorteile einer DRBFM
DRBFM ist eine Methode zur Fehlervermeidung, die in der frühen Planung einer Produktänderung entwicklungsbegleitend eingesetzt wird. Wie jede Methode, muss auch die DRBFM zum richtigen Zeitpunkt angewendet werden. Ist dies der Fall, erhalten Sie folgende Vorteile:
DRBFM ist eine Methode zur Fehlervermeidung, die in der frühen Planung einer Produktänderung entwicklungsbegleitend eingesetzt wird. Wie jede Methode, muss auch die DRBFM zum richtigen Zeitpunkt angewendet werden. Ist dies der Fall, erhalten Sie folgende Vorteile:
| • | Fehlerquellen werden frühzeitig erkannt und systematisch behoben. Damit erhalten Sie ein robustes Design/einen robusten Prozess. |
| • | Durch die zwangslose Kommunikation zwischen den Projektbeteiligten werden unsichtbare Abteilungsbarrieren überwunden und Sie erhalten eine Diskussion und Mitverantwortung aller beteiligten Personen und Abteilungen. |
| • | Der Fokus liegt auf der Änderung, ohne dabei eine komplette FMEA zu betrachten. Dies führt zu Zeit- und Ressourceneinsparung. |
| • | Sie erhalten nach der DRBFM ein robustes Design/einen robusten Prozess und eine Verringerung der internen/externen Fehler. Dies führt zu weniger Ausschuss, Kundenbeschwerden oder Rückrufaktionen. |
| • | Die Änderung wird zielgerichtet und erfolgreich umgesetzt und führt zu Kosteneinsparung im Änderungs- und Zulassungsprozess. |
| • | Die Umsetzung der geplanten Änderung wird innerhalb der vorgegebenen Zeitlinie eingehalten. |
| • | Sie erhalten mit dem Entstehungsprozess eine detaillierte Dokumentationsakte. |
| • | Das Wissensmanagement wird ohne einen zeitlichen und personellen Mehraufwand aufgebaut. |
| • | Sie erhöhen die Akzeptanz der Änderung in der Organisation. |
Drei Elemente des GD3
Fehler präventiv in den frühen Phasen der Produktentwicklung zu beseitigen, ist das Ziel der Philosophie Mizenboushis – oder auch GD3 genannt. GD3 antizipiert potenzielle Fehler kreativ und verhindert Schwierigkeiten, bevor sie entstehen. Mit den drei Elementen Good Design, Good Discussion und Good Dissection (s. Abb. 7) wird der kreative Gedankenaustausch von erfahrenen Experten methodisch durch die Formblätter in der DRBFM unterstützt und geleitet.
Abb. 7: GD3
Fehler präventiv in den frühen Phasen der Produktentwicklung zu beseitigen, ist das Ziel der Philosophie Mizenboushis – oder auch GD3 genannt. GD3 antizipiert potenzielle Fehler kreativ und verhindert Schwierigkeiten, bevor sie entstehen. Mit den drei Elementen Good Design, Good Discussion und Good Dissection (s. Abb. 7) wird der kreative Gedankenaustausch von erfahrenen Experten methodisch durch die Formblätter in der DRBFM unterstützt und geleitet.
GD3 bildet die Basis für ein strukturiertes Vorgehen und ist eine Weiterentwicklung des Kaizengedankens für den Entwicklungsprozess. Änderungen werden durch Vergleiche mit bereits entwickelten und evaluierten Systemkomponenten bzw. im Bereich von Neuentwicklungen auf mögliche Fehler analysiert. Durch detaillierte Betrachtungen der Produktänderungen ist es möglich, die Änderungseinflüsse auf das gesamte Produktsystem zu analysieren. Damit wird die Zuverlässigkeit des Gesamtsystems weiterhin gewährleistet. GD3 bedeutet im Detail:
Good Design − gutes Produktdesign
Das Element „Good Design” steht dafür, dass nur die notwendigsten Änderungen vorgenommen werden. Dabei sollen Sie möglichst viele bewährte, robuste Komponenten und Prozesse einsetzen, die zum Erreichen der gewünschten neuen Funktion führen sollen. Diese Beschränkung auf das Notwendigste verringert die Komplexität der Änderung und führt so zu einer proaktiven Fehlerprävention und senkt die Qualitätskosten (Taguchi).
Das Element „Good Design” steht dafür, dass nur die notwendigsten Änderungen vorgenommen werden. Dabei sollen Sie möglichst viele bewährte, robuste Komponenten und Prozesse einsetzen, die zum Erreichen der gewünschten neuen Funktion führen sollen. Diese Beschränkung auf das Notwendigste verringert die Komplexität der Änderung und führt so zu einer proaktiven Fehlerprävention und senkt die Qualitätskosten (Taguchi).
Praxisbeispiel
Von Produkt A hat sich das Griffdesign bewährt. Dem Kunden gefällt es und in der Produktion ist auch die Ausschussrate sehr gering. Somit wird der Griff A in das neue Produkt B übernommen. Aber im Gegensatz dazu, hat der Kunde die Verpackung bemängelt, mit zu groß, zu schwer und nicht umweltfreundlich. Somit wird bei Produkt B der Fokus auf eine geänderte Verpackung gelegt. Gleichzeitig wünscht der Kunde einen kleineren Katheterdurchmesser für eine bessere Patientenverträglichkeit.
Von Produkt A hat sich das Griffdesign bewährt. Dem Kunden gefällt es und in der Produktion ist auch die Ausschussrate sehr gering. Somit wird der Griff A in das neue Produkt B übernommen. Aber im Gegensatz dazu, hat der Kunde die Verpackung bemängelt, mit zu groß, zu schwer und nicht umweltfreundlich. Somit wird bei Produkt B der Fokus auf eine geänderte Verpackung gelegt. Gleichzeitig wünscht der Kunde einen kleineren Katheterdurchmesser für eine bessere Patientenverträglichkeit.
Good Discussion − gute Diskussion
Das Element „Good Discussion” beginnt zum frühestmöglichen Zeitpunkt im Produktentstehungsprozess. Zentraler Punkt ist die Durchführung der DRBFM, welche die Entwicklungsergebnisse kontinuierlich mit einem Expertenkreis diskutiert und dokumentiert. Dabei werden Fehler bei der Änderung identifiziert. Die Ergebnisse fließen nach sorgfältiger Analyse sofort wieder in den Produktentstehungsprozess ein. Somit werden systematisch alle Arbeitsschritte von der Änderungsanalyse über die Aufnahme von Sorgen bis hin zur Maßnahmendokumentation unterstützt.
Das Element „Good Discussion” beginnt zum frühestmöglichen Zeitpunkt im Produktentstehungsprozess. Zentraler Punkt ist die Durchführung der DRBFM, welche die Entwicklungsergebnisse kontinuierlich mit einem Expertenkreis diskutiert und dokumentiert. Dabei werden Fehler bei der Änderung identifiziert. Die Ergebnisse fließen nach sorgfältiger Analyse sofort wieder in den Produktentstehungsprozess ein. Somit werden systematisch alle Arbeitsschritte von der Änderungsanalyse über die Aufnahme von Sorgen bis hin zur Maßnahmendokumentation unterstützt.
Praxisbeispiel
Die geplante Änderung der Verpackung bespricht der Verpackungsingenieur mit dem Produktdesigner und den Verantwortlichen von der Produktion und Qualitätssicherung. Dabei sollen Mängel frühzeitig aufgedeckt werden, dass beispielsweise:
Die geplante Änderung der Verpackung bespricht der Verpackungsingenieur mit dem Produktdesigner und den Verantwortlichen von der Produktion und Qualitätssicherung. Dabei sollen Mängel frühzeitig aufgedeckt werden, dass beispielsweise:
| • | die Verpackung so stabil ausgewählt wird, dass das Produkt geschützt transportiert, |
| • | die Sterilisationsanforderung erfüllt, |
| • | der Produktionsprozess wie Produkt verpacken und versiegeln durchgeführt werden kann und |
| • | die Qualitätsanforderung der Siegelnaht erfüllt wird. |
Good Dissection − gute Analyse
Das Element „Good Dissection” hat zum Ziel, die Designänderung und die bis dahin vorliegenden Testergebnisse in aller Offenheit in einem Team aus Fachleuten darzustellen und zu diskutieren. Dabei sollen Fehler in Prototypen und in der Vorserie frühzeitig identifiziert werden. Um dies zu beurteilen werden alle Arten von Unterlagen benötigt wie
Das Element „Good Dissection” hat zum Ziel, die Designänderung und die bis dahin vorliegenden Testergebnisse in aller Offenheit in einem Team aus Fachleuten darzustellen und zu diskutieren. Dabei sollen Fehler in Prototypen und in der Vorserie frühzeitig identifiziert werden. Um dies zu beurteilen werden alle Arten von Unterlagen benötigt wie
| • | Änderungs-/Entwicklungsplan |
| • | Zeichnungen, bei denen die Änderungen ersichtlich sind |
| • | Lasten-/Pflichtenheft, Spezifikationen |
| • | Berechnungen (z. B. Vergleich einer Prozessfähigkeitsanalyse Vorher/Nachher) |
| • | Herstelldokumentationen |
| • | Design-/Prozessvalidierungsplan |
| • | Datenblätter usw. |
Weitere Maßnahmen werden gegebenenfalls beschlossen wie:
| • | konstruktive Verbesserungsmaßnahmen, |
| • | Test, DoE, Versuche, Validierung sowie |
| • | Prozessänderungen. |
DRBTR
Im abschließenden DRBTR (Design Review Based on Test Results) werden die Ergebnisse in einem Review aus der Versuchsplanung (DoE = Design of Experiment) über Tests bis zur Validierung zusammengefasst, bewertet und nach positivem Ergebnis verabschiedet.
Im abschließenden DRBTR (Design Review Based on Test Results) werden die Ergebnisse in einem Review aus der Versuchsplanung (DoE = Design of Experiment) über Tests bis zur Validierung zusammengefasst, bewertet und nach positivem Ergebnis verabschiedet.
2.1 Gründe für den Methodenerfolg von DRBFM
Ohne Änderung kein Fortschritt
Es ist eine Herausforderung, die Ingenieure bei Design- oder Prozessänderungen zu einem kreativen Gedankenaustausch mittels des FMEA-Formblatts anzuregen. Bei der notwendigen Teamzusammenstellung mit Qualität, Entwicklung, Produktion, Engineering oder Marketing treffen neben den Abteilungszielen noch unterschiedliche Charaktere, Denkansätze und Erfahrungen aufeinander (s. Abb. 8).
Abb. 8: Projektteam
Es ist eine Herausforderung, die Ingenieure bei Design- oder Prozessänderungen zu einem kreativen Gedankenaustausch mittels des FMEA-Formblatts anzuregen. Bei der notwendigen Teamzusammenstellung mit Qualität, Entwicklung, Produktion, Engineering oder Marketing treffen neben den Abteilungszielen noch unterschiedliche Charaktere, Denkansätze und Erfahrungen aufeinander (s. Abb. 8).
In den 1960er-Jahren fand der amerikanische Gehirnforscher Professor Roger Sperry heraus, dass rechte und linke Hälfte des Großhirns jeweils für unterschiedliche Charaktermerkmale verantwortlich und zudem unterschiedlich stark ausgeprägt sind.